KG Berlin, Urteil vom 10.07.2015, Az. 5 U 154/14
§ 3 UWG, § 4 Nr. 11 UWG a.F.; Art. 5 EGV 1924/2006, Art. 6 EGV 1924/2006, Art. 10 Abs. 1 EGV 1924/2006
Die Zusammenfassung der Entscheidung des KG Berlin finden Sie hier. Im Folgenden haben wir den Volltext des Urteils wiedergegeben:
Kammergericht Berlin
Urteil
1.
Die Berufung der Beklagten gegen das am 10. November 2014 verkündete Urteil der Kammer für Handelssachen 101 des Landgerichts Berlin – 101 O 2/14 – wird mit der Maßgabe zurückgewiesen, dass es im landgerichtlichen Tenor zu Ziffer II. statt „28. März 2014“ richtig heißen muss: „29. März 2014“.
2.
Die Kosten der Berufung hat die Beklagte zu tragen.
3.
Das Urteil ist vorläufig vollstreckbar.
Der Beklagten wird nachgelassen, die Vollstreckung des Klägers wegen der Unterlassungsverpflichtungen durch Sicherheitsleistung in Höhe von 50.000,- € abzuwenden, wenn nicht der Kläger zuvor Sicherheit in gleicher Höhe leistet.
Der Beklagten wird weiter nachgelassen, die Vollstreckung des Klägers wegen der Zahlungsverpflichtung und der Kosten durch Sicherheitsleistung in Höhe des vollstreckbaren Betrages abzuwenden, wenn nicht der Kläger zuvor Sicherheit in Höhe des jeweils zu vollstreckenden Betrages leistet.
4.
Die Revision wird nicht zugelassen.
Gründe
A.
Der Kläger ist ein eingetragener Verein, zu dessen satzungsgemäßen Aufgaben die Wahrung der gewerblichen Interessen seiner Mitglieder, insbesondere die Achtung darauf gehört, dass die Regeln des lauteren Wettbewerbs beachtet werden.
Die Beklagte verbreitete am 28. September 2013 über den TV-Verkaufssender QVC Werbung für Nahrungsergänzungsmittel. Wegen des Inhalts der Werbesendung wird auf die als Anlage K 1 zur Klageschrift vorgelegte Mitschrift verwiesen.
Der Kläger mahnte die Beklagte wegen unzulässiger Werbung während dieser Sendung mit Schreiben vom 4. November 2013 (Anlage K 2 zur Klageschrift) ab.
Der Kläger hat beantragt,
I. die Beklagte unter Androhung der gesetzlichen Ordnungsmittel zu verurteilen, es zu unterlassen, im geschäftlichen Verkehr auf dem deutschen Markt zu werben:
1. für das Mittel „N V M“
1.1 „Denn dieses Produkt macht schlau.“,
1.2 „Es hilft Leuten, sich besser zu erinnern.,
1.3 „Es hilft Leuten, … Dinge nicht mehr zu vergessen.“,
1.4 „Ich kann mir keine Telefonnummern mehr merken… Früher konnten wir das, weil wir das geübt haben. Heute ist das ja größten Teils weg, diese Fähigkeit. Leider! Und wir holen die uns jetzt zurück mit M.“,
1.5 „Und damit diese Nährstoffe aber auch in die hintersten Zellen hineinkommen, brauche ich zunächst mal eine gute Durchblutung. Und dafür haben wir die Substanz Ginkgo Biloba.“,
1.6 „Denn der Ginkgobaum sorgt nachweislich für eine verbesserte Durchblutung der Kapillaren, also der ganz feinen Blutgefäße, die sich im Gehirn dann verästeln, so dass auch tatsächlich die Nährstoffe, die wir zuführen, überhaupt erstmal an jede Zelle rankommen.“,
1.7 „Aber in Prüfungsstress-Situationen kann man’s durchaus auch früher nehmen, um den Körper beim Lernen und beim Konzentrieren zu unterstützen.“,
1.8 „jetzt zugreifen, wenn Sie sich da auch wiederfinden, wenn Sie sich da auch erkennen mit diesen leichten Gedächtnisschwächen … All diese kleinen Konzentrationsschwächen. Oder wenn Sie merken, dass Sie beim Sprechen öfter mal Worte ersetzen durch „Äh“ und „Dings“ und so weiter.“,
1.9 „Wassernabel … wird in der Ayurvedischen Medizin verwendet als Nerventonikum, also einfach zur Unterstützung des Nervensystems. Damit man ein bisschen belastbarer ist.“,
1.10 „… Darum gibt es einen Türsteher, der das Wichtige vom Unwichtigen trennt. Und dieser Stoff heißt GABA. Wenn GABA nicht ausreichend vorhanden ist, und im Alter nimmt die GABA-Verwertung leider ab, dann können wir uns nicht mehr konzentrieren, weil zu viele Reize gleichzeitig auf uns einstürmen.“,
1.11 „Wir haben da den asiatischen Wassernabel. Das ist eine Pflanze aus der ayurvedischen Medizin, die als Tonikum für die Nerven gilt. Das bedeutet, sie steigert die Leistungs- und Denkfähigkeit und mindert Ermüdungserscheinungen.“,
1.12 „Und bei dieser Beurteilung, was ist wichtig und was ist nicht so wichtig für mein Gehirn, da hilft GABA als hemmender Neurotransmitter.“
1.13 „Und nicht nur, dass wir unser Gehirn entlasten und vor Überreizungen schützen können, sondern wir werden obendrein auch noch ein klein wenig glücklicher mit einer weiteren ayurvedischen Zutat, nämlich dem Ferula Blatt. Das Ferula Blatt setzt Endorphine frei … das sind Glückshormone. Das stimmt. Wenn die Endorphine freigesetzt werden, dann geht es uns besser. Wir fühlen uns wohler. Wir fühlen uns ausgeglichener. Vor allen Dingen können wir uns aber in diesen Momenten auch besser konzentrieren.“,
2. für das Mittel „N V H“:
2. 1 mit der bildlichen Darstellung:
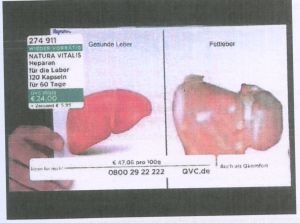
„Achtung, jeder Fünfte hat mittlerweile eine Leber, die so aussieht. Das ist eine Fettleber. Ja? Sie können schon sehen, diese Fettstreifen, die da drin sind, die Farbe hat sich verändert. Es ist gelblich geworden. Und die Form verändert sich. Die ganze Leber wird dadurch auch größer, durch diese Verfettung. Und darum habe ich eben gesagt, wenn Sie die Leber von außen tasten können, dann sind Sie schon am Anfang des Problems.
Die Leber selbst spürt keinen Schmerz. Und das ist ja das Gefährliche daran … Die Leber leidet stumm. Und darum müssen wir Vorsorge treffen und dafür sorgen, dass die Leberfunktion unterstützt wird. Und das können wir mit den Stoffen in H.“
und
„Und, zu guter Letzt, haben wir auch noch Cholin enthalten, in H. Und Cholin kann dieser Leberverfettung entgegenwirken.“,
2.2 „Da sind nämlich lauter pflanzliche Stoffe enthalten, die die Leberfunktion anregen und die Leberzellen stärken können. Also wir haben da drin Löwenzahn, Mariendistel, Artischocke und Chicoree.“,
2.3 „Und damit dieser Kreislauf funktioniert, wir genug Gallenflüssigkeit bilden können, und die auch entsprechend ausgeschüttet und wieder aufgenommen und umgebaut wird, müssen wie diesen Fluss anregen mit Löwenzahn und Chicoree.“,
2.4 „Mariendistel ist eine sensationelle Pflanze, die die Membran der Leberzelle stärkt und somit die Zelle weniger angreifbar macht für Umweltgifte.“,
sofern dies geschieht wie in der auf dem TV-Sender „QVC“ ausgestrahlten Dauerwerbesendung „N V – …“ vom 28. September 2013 (Anlage K 1),
II. die Beklagte zu verurteilen, an ihn 166,60 € nebst Zinsen in Höhe von 5 Prozentpunkten über dem Basiszins seit Rechtshängigkeit zu zahlen.
Die Beklagte hat beantragt, die Klage abzuweisen.
Mit dem am 10. November 2014 verkündeten Urteil hat das Landgericht der Klage stattgegeben. Es wird insoweit auf das erstinstanzliche Urteil verwiesen, und zwar auch hinsichtlich des weitergehenden erstinstanzlichen Vortrages der Parteien.
Die Beklagte wendet sich mit der Berufung gegen dieses Urteil. Sie wiederholt und vertieft ihren erstinstanzlichen Vortrag.
Die Beklagte beantragt, das am 10. November 2014 verkündete Urteil der Kammer für Handelssachen 101 des Landgerichts Berlin – 101 O 2/14 – zu ändern und die Klage abzuweisen.
Der Kläger beantragt, die Berufung der Beklagten zurückzuweisen.
Wegen der weiteren Einzelheiten des Vorbringens der Parteien wird auf den vorgetragenen Inhalt der gewechselten Schriftsätze nebst Anlagen verwiesen.
B.
Die Berufung der Beklagten ist statthaft und zulässig, insbesondere auch form- und fristgerecht eingelegt worden. Die Berufung der Beklagten ist jedoch weit überwiegend nicht begründet.
1.
Der Kläger hat gegen die Beklagte einen Anspruch auf Unterlassung der im Tenor des angegriffenen Urteils unter 1. aufgelisteten Werbeaussagen über das Nahrungsergänzungsmittel „N V M“.
Der Unterlassungsanspruch ergibt sich aus § 8 Abs. 1 und 3 Nr. 2, §§ 3, 4 Nr. 11 UWG i.V.m. Art. 10 Abs. 1 der Verordnung (EG) Nr. 1924/2006 des Europäischen Parlaments und des Rates vom 20. Dezember 2006 über nährwert- und gesundheitsbezogene Angaben über Lebensmittel (im Folgenden: HCVO).
a)
Das Landgericht ist zu Recht davon ausgegangen, dass es sich bei sämtlichen angegriffenen Werbeaussagen über das Mittel „N V M“ um gesundheitsbezogene Angaben im Sinne des Art. 2 Abs. 2 Nr. 5 HCVO handelt.
Dies greift auch die Berufung nicht an.
In der Klageerwiderung hat die Beklagte noch beanstandet, der Kläger habe einzelne Aussagen aus ihrer Werbesendung isoliert und aus dem Zusammenhang gerissen zum Gegenstand seines Anträge gemacht.
Dies trifft jedoch nicht zu.
Der Kläger begehrt das Verbot der im einzelnen aufgelisteten Aussagen nur „sofern dies geschieht wie in der auf dem TV-Sender „QVC“ ausgestrahlten Dauerwerbesendung „N V – …“ vom 28. September 2013, Anlage K 1″, d.h. beschränkt auf die konkrete Verletzungsform. Danach stehen alle Aussagen unter der „Überschrift“ „Memophal für das Gedächtnis“.
Gesundheitsbezogene Angaben sind nach Art. 10 Abs. 1 HCVO verboten, wenn sie nicht den allgemeinen Anforderungen gemäß Art. 3 bis 7 HCVO und den speziellen Anforderungen gemäß Art. 10 bis 19 HCVO genügen und gemäß der Verordnung zugelassen und in die Liste der zugelassenen Angaben gemäß Art. 13, 14 HCVO aufgenommen sind.
b)
Das Landgericht ist weiter zu Recht davon ausgegangen, dass es sich bei diesen Aussagen um gesundheitsbezogene Aussagen im Sinne des Art. 10 Abs. 1 HCVO handelt und nicht um Verweise auf allgemeine, nicht spezifische Vorteile des Lebensmittels für die Gesundheit im Allgemeinen oder das gesundheitsbezogene Wohlbefinden im Sinne des Art. 10 Abs. 3 HCVO.
c)
Die vom Klägerin beanstandeten Aussagen über das Nahrungsergänzungsmittel „N V M“ sind in der nach Art. 13 Abs. 3 HCVO erlassenen Verordnung (EU) 432/2012 der Kommission vom 16. Mai 2012 zur Festlegung einer Liste zulässiger anderer gesundheitsbezogener Angaben über Lebensmittel als Angaben über die Reduzierung eines Krankheitsrisikos sowie die Entwicklung und die Gesundheit von Kindern (im Folgenden: Verordnung (EU) 432/2012) nicht enthalten.
In der Liste über zulässige gesundheitsbezogene Aussagen im Anhang der Verordnung (EU) 432/2012 sind zwar Aussagen über Eisen, Folat, Kupfer, Pantothensäure, Riboflavin und Vitamin C aufgeführt, also über Stoffe, die nach der Darstellung der Beklagten in diesem Rechtsstreit in dem Produkt „N V M“ enthalten sein sollen.
Aus diesen Eintragungen kann die Beklagte die Zulässigkeit der beanstandeten Aussagen jedoch nicht herleiten.
aa)
Zu Eisen, Folat, Kupfer, Pantothensäure, Riboflavin und Vitamin C hat die Beklagte vorgetragen, welche Mengen in der Tagesverzehrmenge enthalten sein sollen.
Zu allen hier in Betracht kommenden zugelassen Aussagen über diese Vitamine und Mineralstoffe heißt es im Anhang der Verordnung (EU) 432/2012, die jeweils zugelassene Angabe dürfe nur für Lebensmittel verwendet werden, die die Mindestanforderungen an jeweilige Vitamin- oder Mineralstoffquelle gemäß der im Anhang der Verordnung (EG) Nr. 1924/2006 aufgeführten Angabe [NAME DES VITAMINS/DER VITAMINE] UND/ODER [NAME DES MINERALSTOFFS/DER MINERALSTOFFE]-QUELLE erfüllen.
Nach dem Anhang zur HCVO ist die Angabe, ein Lebensmittel sei eine Vitaminquelle oder Mineralstoffquelle, sowie jegliche Angabe, die für den Verbraucher voraussichtlich dieselbe Bedeutung hat, nur zulässig, wenn das Produkt mindestens eine gemäß dem Anhang der Richtlinie 90/496/EWG signifikante Menge oder eine Menge enthält, die den gemäß Art. 6 der Verordnung (EG) Nr. 1925/2006 des Europäischen Parlaments und des Rates vom 20. Dezember 2006 über den Zusatz von Vitaminen und Mineralstoffen sowie bestimmten anderen Stoffen zu Lebensmittelnzugelassenen Abweichungen entspricht.
Auf der Grundlage des Vortrages der Beklagten kann danach davon ausgegangen werden, dass die hier zu beurteilenden Vitamine und Mineralstoffe in dem beworbenen Produkt „M“ jeweils in ausreichender Menge enthalten sind.
bb)
Jedoch rechtfertigt keine der nach dem Anhang der Verordnung (EU) 432/2012 zulässigen Aussagen über Eisen, Folat, Kupfer, Pantothensäure, Riboflavin und Vitamin C die hier streitgegenständlichen Aussagen inhaltlich.
aaa)
Zulässig sind zwar die Angaben „Eisen trägt zu einer normalen kognitiven Funktion bei“ und „Pantothensäure trägt zu einer normalen geistigen Leistung bei“.
Es kann jedoch keine Rede davon sein, dass der Wortlaut der beanstandeten Werbeaussagen aus der maßgeblichen Verbrauchersicht gleichbedeutend wäre mit demjenigen einer zugelassenen gesundheitsbezogenen Angabe (vgl. hierzu Erwägungsgrund 9 der Verordnung (EU) Nr. 432/2012). Die zulässigen Aussagen über Eisen und Pantothensäure bleiben hinsichtlich des Wirkungsgrades deutlich hinter den beanstandeten Aussagen zurück.
Wenn die zulässigen „Claims“ für Pantothensäure und Eisen sich auf die Aussagen beschränken, der Stoff trage zu einer normalen geistigen Leistung bei bzw. er trage zu einer normalen kognitiven Funktion bei, ist nicht zu erkennen, wie dies Aussagen rechtfertigen soll, das Produkt „N V M“ mache schlau (Verbot zu 1.1), helfe Leuten, sich besser zu erinnern, (Verbot zu 1.2) bzw. Dinge nicht mehr zu vergessen (Verbot zu 1.3), hole die Merkfähigkeit zurück (Verbot zu 1.4), unterstütze den Körper beim Lernen und Konzentrieren unter Stress in Prüfungssituationen (Verbot zu 1.7) oder steigere die Leistungs- und Denkfähigkeit (Verbot zu 1.11).
Entsprechendes gilt jedenfalls im Zusammenhang der konkreten Verletzungsform für die Aufforderung, bei leichten Gedächtnis- oder Konzentrationsschwächen auf das Produkt zuzugreifen (Verbote zu 1.8 und 1.13).
Soweit es um die Aussagen geht, Ginkgo Biloba bewirke eine gute Durchblutung (Verbot zu 1.5), der Gingkobaum sorge nachweislich für verbesserte Durchblutung der Kapillaren (Verbot zu 1.6), Wassernabel sei ein Nerventonikum aus der ayurvedischen Medizin und mache belastbarer (Verbot zu 1.9), GABA helfe dem Gehirn bei der Beurteilung, was wichtig und war unwichtig sei (Verbot zu 1.12), ist nicht dargetan, dass diese Stoffe überhaupt Pantothensäure und Eisen bzw. Folat, Kupfer, Riboflavin oder Vitamin C enthalten.
bbb)
Keine der beanstandeten Aussagen bezieht sich auf Eisen, Folat, Kupfer, Pantothensäure, Riboflavin oder Vitamin C. Die Aussagen beziehen sich allgemein auf das aus mehreren Stoffen bestehende Produkt „N V M“ oder andere Inhaltsstoffe des Nahrungsergänzungsmittels.
Gesundheitsbezogene Angaben dürfen aber nur für den jeweiligen Nährstoff, die Substanz oder das Lebensmittel gemacht werden, für die sie zugelassen sind, nicht jedoch für das Lebensmittelprodukt, das diese enthält (vgl. OLG Bamberg WRP 2014, 609).
Die EU-Kommission hat auf ihrer Seite http://ec.europa.eu/nuhclaims/ folgenden Hinweis unter der Überschrift „Terms and Conditions“ veröffentlicht, der erscheint, wenn der Besucher der Seite das „EU-Register of Nutrition and Health Claims“ aufrufen will:
„Health claims should only be made for the nutrient, substance, food or food category for which they have been authorized, and not for the food product that contains them.“.
Diesen Hinweis hat das OLG Bamberg wie folgt ins Deutsche übersetzt:
„Gesundheitsbezogene Angaben dürfen nur für den Nährstoff, die Substanz, das Lebensmittel oder die Lebensmittelkategorie gemacht werden, für die sie zugelassen sind und nicht für das Lebensmittelprodukt, das diese enthält.“.
Zweifel an der Richtigkeit dieser Übersetzung hat der Senat nicht, insbesondere ist die Übertragung von „Health claims should only be made” in „Gesundheitsbezogene Angaben dürfen nur … gemacht werden” korrekt. In der englischen Rechtssprache werden die Wörter „shall” und „should” zur Bezeichnung einer Mussbestimmung (vgl. Langenscheidts Großwörterbuch, Der Kleine Muret-Sanders, Englisch-Deutsch, 3. Auflage), d.h. einer zwingenden Bestimmung (Romain/Bader/Byrd, Dictionary of Legal und Commercial Terms, 5. Aufl.) benutzt.
Der oben wiedergegebenen grundsätzlich unverbindlichen Rechtsauffassung der EU-Kommission ist zu folgen (vgl. auch OLG Bamberg WRP 2014, 609).
Art. 13 Abs. 3 HCVO begründet die Befugnis der Kommission, eine Gemeinschaftsliste zulässiger Angaben sowie aller für die Verwendung dieser Angaben notwendigen Bedingungen zu verabschieden. Dementsprechend bestimmt Art 20 Abs. 2 lit. c) HCVO, dass das Register sowohl die zugelassenen gesundheitsbezogenen Angaben als auch die Bedingungen für ihre Verwendung, etwa nach Art. 13 Abs. 3 und 5 HVCO, enthält.
Wenn es danach zu der z.B. zugelassenen Angabe „Folat trägt zur normalen psychischen Funktion bei“ unter der Überschrift „Bedingungen für die Verwendung der Angabe“ heißt: „Die Angabe darf nur für Lebensmittel verwendet werden, die die Mindestanforderungen an eine Folatquelle … erfüllen.“ besteht schon dem Wortlaut des Registers nach kein Anlass, dies so zu verstehen, dass der Name dieses Vitamins durch den Namen eines Produkts ersetzt werden kann, das dieses Vitamin enthält. (vgl. OLG Bamberg WRP 2014, 609)
Wenn die Kommission im Erwägungsgrund 9 der Verordnung (EU) Nr. 432/2012 gleichbedeutende Angaben in engem Rahmen zugelassen hat, bezieht sich dies lediglich auf sinngemäße Formulierungen wie z.B. „Folat leistet einen Beitrag zu einer normalen psychischen Funktion.“ (vgl. OLG Bamberg WRP 2014, 609).
Auch wenn der oben wiedergegebene Hinweis der EU-Kommission keine rechtliche Verbindlichkeit hat, ist er bei der Auslegung des Willens des EU-Gesetzgebers zu berücksichtigen. Dieser Hinweis stützt die Auslegung, dass ausschließlich mit den gesundheitsbezogenen Angaben so wie in der Liste angeführt, also mit den einzelnen Nährstoffen oder Substanzen, geworben werden darf und eben nicht mit dem Lebensmittelprodukt, das diese Stoffe enthält. (vgl. OLG Bamberg WRP 2014, 609)
Die Auffassung der Beklagten, es mache keinen Sinn, den konkreten Nährstoff des Lebensmittels zu nennen, weil der Verbraucher nicht den Nährstoff, sondern das Produkt kaufen wolle, ist mit den Zielen der HCVO nicht vereinbar. Der Erwägungsgrund 9 der HCVO verdeutlicht, dass nach dem Willen des Verordnungsgebers sichergestellt werden soll, dass gesundheitsbezogene Angaben wahrheitsgemäß, klar, verlässlich und für den Verbraucher hilfreich sind. Diesen Vorgaben genügen die beanstandeten Werbeaussagen über das Produkt „N V M“ nicht, da ihnen nicht zu entnehmen ist, welche Nährstoffe in dem Produkt enthalten sind und für das Gedächtnis hilfreich sein sollen. (vgl. OLG Bamberg WRP 2014, 609)
Das Informationsbedürfnis des Verbrauchers in diesem Punkt liegt auf der Hand.
Es kommt dem Durchschnittsverbraucher keineswegs nur auf die Erkenntnis an, dass der Konsum eines Lebensmittels oder Produkts zur Verringerung von Müdigkeit beiträgt (so aber: Teufer GRUR-Prax 2012, 476, 477). Ist dies der Fall, weil das Lebensmittel oder Produkt Vitamin C enthält, ist gerade dieses Wissen für den Verbraucher von maßgeblicher Bedeutung, wenn er den Tagesbedarf an Vitamin C bereits mit seiner sonstigen Nahrung aufgenommen hat und eine weitere Zufuhr dieses Vitamins für ihn nutzlos ist.
d)
Der Einwand der Beklagten, angesichts der in der Berufungsbegründung aufgeführten „Claims“ für die „Botanicals“ Mariendistel, Artischocke, Löwenzahn und wilden Chicorée könne sie die beanstandeten Werbeaussagen jedenfalls noch bis zu sechs Monate nach Erlass der noch nicht vorliegenden Entscheidung über die Zulässigkeit dieser „Claims“ benutzen, verfängt nicht.
Zum einen hat die Beklagte schon nicht dargetan, dass sie die streitgegenständlichen Werbeaussagen über „N V M“ schon vor dem nach Art. 28 Abs. 6 HCVO maßgeblichen Stichtag, dem Inkrafttreten der HCVO, verwendet hat.
Überdies bezieht sich keine der für das Produkt „N V M“ verwendeten Werbeaussagen auf Mariendistel, Artischocke, Löwenzahn oder wilden Chicorée.
Zum anderen enthält Art. 28 Abs. 6 HCVO Übergangsregelungen nur für gesundheitsbezogene Angaben, die nicht unter Art. 13 Absatz 1 Buchstabe a und Artikel 14 HCVO fallen. Hier geht es aber gerade um gesundheitsbezogene Angaben, die die Bedeutung eines Nährstoffs oder einer anderen Substanz für Körperfunktionen beschreiben, also Angaben im Sinne des Art.13 Absatz 1 lit. a) HCVO.
Dem Erwägungsgrund 13 der Verordnung (EU) Nr. 432/2012 und dem Erwägungsgrund 14 der Verordnung (EU) Nr. 536/2013 sind entgegen der Auffassung der Beklagten nicht zu entnehmen, dass Art. 28 Abs. 6 HCVO im vorliegenden Fall anzuwenden ist. Die genannten Erwägungsgründe verhalten sich zum Anwendungsbereich des Art. 28 Abs. 6 HCVO nicht.
Auf die einschlägige Übergangsvorschrift in Art. 28 Abs. 5 HCVO kann die Beklagte sich nicht berufen, da die streitgegenständlichen Werbeaussagen über „N V M“ wie im Folgenden ausgeführt wird, nicht der HCVO entsprechen.
e)
Die gesundheitsbezogenen Angaben der Beklagten genügen den allgemeinen Anforderungen nach Art. 5 und 6 HCVO nicht.
Soweit in den beanstandeten Aussagen über „N V M“ konkrete Bestandteile angesprochen werden, soll wohl vorgetragen werden, die Substanz Ginkgo Biloba bewirke eine gute Durchblutung (Verbot zu 1.5), der Gingkobaum sorge nachweislich für verbesserte Durchblutung der Kapillaren (Verbot zu 1.6), Wassernabel sei ein Nerventonikum aus der ayurvedischen Medizin und mache belastbarer (Verbot zu 1.9), GABA-Zufuhr erhöhe die Konzentrationsfähigkeit (Verbot zu 1.10), Wassernabel steigere die Leistungs- und Denkfähigkeit und mindere Ermüdungserscheinungen (Verbot zu 1.11), GABA helfe dem Gehirn bei der Beurteilung, was wichtig und was unwichtig sei (Verbot zu 1.12), Ferulablatt setze Endorphine frei und helfe, sich besser zu konzentrieren (Verbot zu 1.13).
Auch mit Pflanzen- und sonstigen (etwa aus Tieren gewonnenen) Wirkstoffen darf aber nur geworben werden, wenn die weiteren Vorschriften in Art. 5 und 6 HCVO eingehalten sind.
Das erfordert grundsätzlich, dass durch allgemein anerkannte wissenschaftliche Nachweise abgesichert ist, dass das Vorhandensein des betreffenden Stoffs die beworbene positive ernährungsbezogene oder physiologische Wirkung hat (Art. 5 Abs. 1 lit. a, Art. 6 Abs. 1 HCVO).
Welche Anforderungen an den von einem Verwender gesundheitsbezogener Angaben zu führenden Wirksamkeitsnachweis zu stellen sind, kann hier weitgehend dahingestellt bleiben, ebenso die Erörterung, ob es sich bei sämtlichen eingangs angeführten Stoffen um pflanzliche Stoffe, sogenannte Botanicals, handelt.
Die von der Beklagten in den Rechtsstreit eingeführten Unterlagen reichen für den erforderlichen Nachweis einer wissenschaftlichen Absicherung ihrer Aussagen jedenfalls nicht aus.
Es gibt keinen Anlass, hier geringere Anforderungen zu stellen, als diejenigen für ein vereinfachtes Registrierungsverfahren für pflanzliche Arzneimittel gemäß Art. 16a Abs. 1 lit. e) der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel. Für diese ist aber nach Art. 16 a Abs. 1 lit. e) dieser Richtlinie nachzuweisen, dass das Produkt unter den angegebenen Anwendungsbedingungen unschädlich ist und dass die pharmakologischen Wirkungen oder die Wirksamkeit des Arzneimittels aufgrund langjähriger Anwendung und Erfahrung plausibel sind. Der der Umsetzung dieser Vorgaben dienende § 39b Abs. 1 Nr. 4 AMG fordert dementsprechend bibliographische Angaben über die traditionelle Anwendung oder Berichte von Sachverständigen, aus denen hervorgeht, dass das betreffende oder ein entsprechendes Arzneimittel zum Zeitpunkt der Antragstellung seit mindestens 30 Jahren, davon mindestens 15 Jahre in der Europäischen Union, medizinisch oder tiermedizinisch verwendet wird, das Arzneimittel unter den angegebenen Anwendungsbedingungen unschädlich ist und dass die pharmakologischen Wirkungen oder die Wirksamkeit des Arzneimittels auf Grund langjähriger Anwendung und Erfahrung plausibel sind.
Die Auffassung der Beklagten, für den Wirkungsnachweis von Nahrungsergänzungsmitteln seien geringere Anforderungen zu stellen als für die Wirksamkeit traditioneller pflanzlicher Arzneimittel ist mit den Vorstellungen, die der Verordnungsgeber mit der HCVO umsetzen wollte, nicht vereinbar (vgl. insbesondere die Erwägungsgründe 14 und 17 der HCVO).
aa)
Gingko Biloba
Bei der Anlage BK 2 handelt es sich um einen populärwissenschaftlichen Artikel über „Ginkgo biloba Blätter-Extrakt“, veröffentlicht unter www.docjones.de, nach Eigendarstellung „Deutschlands größtes Portal für grüne Medizin“, der offensichtlich keine eigenen Erfahrungen und Beobachtungen des namentlich nicht benannten Autors schildert, die Quellen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse aber auch nicht nennt und somit den Anforderungen an den erforderlichen Nachweis nicht genügt.
Bei der Anlage BK 3 handelt es sich um einen populärwissenschaftlichen Artikel über „Ginkgo“, veröffentlicht in der Apotheken-Umschau, der ausdrücklich klarstellt, dass sich derzeit nicht sicher sagen lasse, ob Ginkgo tatsächlich das Gedächtnis beeinflussen könne und auf unterschiedliche Studienergebnisse hinweist. (Tatsächlich hat auch die Beklagte in der Erwiderung auf die Abmahnung im Schreiben ihres Bevollmächtigten vom 18. November 2013, Anlage K 3 zur Klageschrift, noch ausgeführt, verschiedene Studien zur Frage, ob Ginkgo Biloba die Durchblutung unterstütze, seien zu unterschiedlichen Ergebnissen gekommen.)
Die Anlage BK 4 enthält einen Überblick und eine Metaanalyse über Ginkgo Biloba bei neuropsychiatrischen Störungen in englischer Sprache. Soweit ersichtlich werden die Wirkungen von Ginkgo Biloba bei nachlassender Gedächtnisleistung und Konzentrationsfähigkeit und in diesem Zusammenhang auf die Durchblutung dort nicht erörtert. Wenn die Beklagte auf die Erörterung der Wirkung des Stoffs bei Behandlung von Demenz verweisen will, sind dem die in dem Artikel ausgewiesenen Dosierungen entgegen zu halten, dass diese weitaus höher sind, als die Konzentration von Gingko Biloba-Extrakt im Produkt der Beklagten. Überdies gibt schon der Inhalt des vorerwähnten Artikels in der Apotheken-Umschau Anlass zu Zweifeln, ob sich Erkenntnisse zur Wirkung bei der Behandlung von Alzheimer und Demenz auf Gesunde übertragen lassen.
bb)
Wassernabel
Bei der Anlage BK 5 handelt es sich um einen populärwissenschaftlichen Artikel über „Wassernabel“, veröffentlicht unter www.phytodoc.de, nach Eigendarstellung „Ihr Portal für Gesundheit, Naturheilkunde und Heilpflanzen“, der offensichtlich keine eigenen Erfahrungen und Beobachtungen des namentlich nicht benannten Autors schildert, der die Quellen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse aber auch nicht nennt und somit den Anforderungen an den erforderlichen Nachweis nicht genügt.
cc)
GABA
Bei der Anlage BK 6 handelt es sich um einen Beitrag zu „GABA – Balsam für das Nervensystem“, veröffentlicht unter www.zeinpharma.de, dem Internetauftritt eines Anbieters von Nahrungsergänzungsmitteln, also Werbung für die eigenen Produkte des Mitbewerbers der Beklagten.
Da der Beitrag überdies offensichtlich keine eigenen Erfahrungen und Beobachtungen des Autors schildert, die Quellen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse aber auch nicht nennt, genügt er den Anforderungen an den erforderlichen Nachweis nicht.
Das als Anlage BK 7 vorgelegte einzelne Blatt verhält sich – soweit ersichtlich – in englischer Sprache zu einer japanischen Studie über die Auswirkungen der Gabe von entfetteter und mit Gamma-Aminobuttersäure angereicherter Reishefe (GABA) auf Schlaflosigkeit, Depression und vegetative Störungen, nicht aber zu den hier beworbenen Wirkungen bei nachlassender Gedächtnisleistung und Konzentrationsfähigkeit.
dd)
Des weiteren fehlt es aber auch an einer Grundlage für den von der Beklagten nach Art. 6 Abs. 1 HCVO zu führenden Nachweis, dass die fraglichen Stoffe in den Produkten der Beklagten jeweils in relevanter Menge (Art. 5 Abs. 1 lit. b HCVO) und bioverfügbarer Form (Art. 5 Abs. 1 lit. c der HCVO) enthalten sind und bei einem vernünftigerweise zu erwartenden Verzehr die von der Beklagten behauptete Wirkung zu erzielen vermögen (Art. 5 Abs. 1 lit. d der HCVO). In diesem Zusammenhang ist insbesondere zu berücksichtigen, dass die Verwendung der entsprechenden Angaben nach dem insoweit eindeutigen Wortlaut der genannten Bestimmungen nur dann zulässig ist, wenn die behauptete positive Wirkung der jeweiligen Substanz bereits zu dem Zeitpunkt anhand allgemein anerkannter wissenschaftlicher Erkenntnisse nachgewiesen ist, zu dem die Angaben gemacht werden. (vgl. BGH GRUR 2013, 958 – Vitalpilze, Rn 21)
f)
Art. 10 Abs. 1 HCVO ist ebenso wie Art. 5 Abs. 1 HCVO eine Marktverhaltensvorschrift im Sinne des § 4 Nr. 11 UWG (vgl. BGH GRUR 2013, 958 – Vitalpilze, Rn 22).
2.
Der Kläger hat gegen die Beklagte einen Anspruch auf Unterlassung der im Tenor des angegriffenen Urteils unter 1. aufgelisteten Werbeaussagen über die Nahrungsergänzungsmittel „N V H“.
Der Unterlassungsanspruch ergibt sich aus § 8 Abs. 1 und 3 Nr. 2, §§ 3, 4 Nr. 11 UWG i.V.m. Art. 10 Abs. 1 HCVO.
a)
Das Landgericht ist zu Recht davon ausgegangen, dass es sich bei sämtlichen angegriffenen Werbeaussagen über das Mittel „N V H“ um gesundheitsbezogene Angaben im Sinne des Art. 2 Abs. 2 Nr. 5 HCVO handelt.
Die Ausführungen zu dem Produkt „N V M“ gelten hier entsprechend.
b)
Die vom Klägerin beanstandeten Aussagen über das Nahrungsergänzungsmittel „N V H“ sind in der nach Art. 13 Abs. 3 HCVO erlassenen Verordnung (EU) 432/2012 nicht enthalten.
In der Liste über zulässige gesundheitsbezogene Aussagen im Anhang der Verordnung (EU) 432/2012 sind zwar Aussagen über Cholin enthalten.
Aus diesen Eintragungen kann die Beklagte die Zulässigkeit der beanstandeten Aussagen jedoch nicht herleiten.
Auf der Grundlage des Vortrages der Beklagten kann davon ausgegangen werden, dass Cholin in dem beworbenen Produkt „M“ jeweils in ausreichender Menge enthalten ist, also mindestens 82,5 mg je 100 g oder 100 ml bzw. je Portion Lebensmittel Cholin.
Jedoch rechtfertigt keine der nach dem Anhang der Verordnung (EU) 432/2012 der Kommission vom 16. Mai 2012 zulässigen Aussagen über Cholin die hier streitgegenständlichen Aussagen inhaltlich.
Nur eine der beanstandeten Aussagen bezieht sich auf Cholin (Verbot zu 2.1). Die anderen Aussagen beziehen sich allgemein auf das aus mehreren Stoffen bestehende Produkt „N V H“ oder andere Inhaltsstoffe des Nahrungsergänzungsmittels.
Für Cholin zugelassen sind die Claims:
– Cholin trägt zu einem normalen Homocystin-Stoffwechsel bei
– Cholin trägt zu einem normalen Fettstoffwechsel bei
– Cholin trägt zur Erhaltung einer normalen Leberfunktion bei.
Der Kläger beanstandet jedoch vor dem Hintergrund der Abbildung einer sogenannten „Fettleber“, die jeder Fünfte mittlerweile haben soll, die Behauptung: „Und zu guter Letzt, haben wir auch noch Cholin enthalten. Und Cholin kann dieser Leberverfettung entgegenwirken.“, die suggeriert, dass Cholin die zu einer Fettleber führende Entwicklung rückgängig machen kann.
Es kann mithin keine Rede davon sein, dass der Wortlaut der beanstandeten Werbeaussagen aus der maßgeblichen Verbrauchersicht gleichbedeutend wäre mit demjenigen einer zugelassenen gesundheitsbezogenen Angabe (vgl. hierzu Erwägungsgrund Nr. 9 der Verordnung (EU) Nr. 432/2012 der Kommission vom 16. Mai 2012).
Keiner der für die in der Werbung nicht angesprochenen Stoffe, aber nach Darstellung der Beklagten im Produkt enthaltenen Vitamine B1 und B2 sowie für die danach ebenfalls enthaltenen Stoffe Niacen und Pantothensäure zugelassenen „Claims“ geht so weit, dass er die beanstandeten Aussagen über „N V H“ deckt.
bb)
Soweit in den beanstandeten Aussagen über „N V H“ konkrete Bestandteile angesprochen werden, soll wohl vorgetragen werden, Löwenzahn, Mariendistel, Artischocke und Chicorée könnten die Leberfunktion anregen und die Leberzellen stärken (Verbot zu 2.2), Löwenzahn und Chicorée regten den Gallenfluss an (Verbot zu 2.3) und Mariendistel stärke die Membran der Leberzelle und mache sie so weniger angreifbar für Umweltgifte.
Auch derartige Werbeaussagen sind an Art. 5 und 6 HCVO zu messen.
Es muss danach grundsätzlich durch allgemein anerkannte wissenschaftliche Nachweise abgesichert sein, dass das Vorhandensein des betreffenden Stoffs die beworbene positive ernährungsbezogene Wirkung oder physiologische Wirkung hat (Art. 5 Abs. 1 lit. a, Art. 6 Abs. 1 HCVO).
Welche Anforderungen an den von einem Verwender gesundheitsbezogener Angaben zu führenden Wirksamkeitsnachweis zu stellen sind, kann auch hier weitgehend dahingestellt bleiben, ebenso die Erörterung, ob es sich bei sämtlichen eingangs angeführten Stoffen um pflanzliche Stoffe, sogenannte Botanicals, handelt.
Die von der Beklagten in den Rechtsstreit eingeführten Unterlagen reichen für den erforderlichen Nachweis einer wissenschaftlichen Absicherung ihrer Aussagen jedenfalls nicht aus.
Es gibt – wie oben ausgeführt – keinen Anlass, hier geringere Anforderungen zu stellen, als diejenigen für ein vereinfachtes Registrierungsverfahren für pflanzliche Arzneimittel gemäß Art. 16a Abs. 1 lit. e) der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel.
aaa)
Mariendistel
Der als Anlage BK 9 vorgelegte wikipedia-Artikel äußert sich erkennbar distanziert zu den Wirkungen der Silberdistel („Der Wirkstoffkomplex Silibinum soll leberschützend (hepatoprotektiv), leberstärkend, entgiftend und den Gallenfluss sowie die Zirkulation anregend wirken“), und ist schon deshalb nicht geeignet, die behaupteten Werbeaussagen abzusichern.
Bei der Anlage BK 10 handelt es sich um einen populärwissenschaftlichen Artikel über „Mariendistel“, veröffentlicht in der Apotheken-Umschau, der offensichtlich keine eigenen Erfahrungen und Beobachtungen der Autorin schildert, der auch die Quellen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse nicht nennt und somit den Anforderungen an einen erforderlichen Nachweis nicht genügt. Hinzu kommt, dass die Wirkung der Mariendistel gegenüber einer Leberverfettung weitaus zurückhaltender beschrieben werden als in der Werbung der Beklagten („Studien sprechen dafür, dass Extrakte aus Mariendistelfrüchten das Fortschreiten mancher Leberkrankheiten, etwa einer Leberverfettung, verlangsamen können.“) und nicht dargetan ist, dass das beworbene Produkt der Beklagten überhaupt Extrakte aus Mariendistelfrüchten enthält.
Die Anlage BK 11 enthält Werbung für hochdosierte Kapseln mit Trockenextrakt aus Mariendistelfrüchten. Überdies ist weder dargetan, dass das Produkt der Beklagten Trockenextrakt aus Mariendistelfrüchten enthält, noch dargelegt, dass das Produkt der Beklagten eine entsprechende Konzentration dieses Extrakts enthält.
Bei der Anlage BK 12 handelt es sich um einen populärwissenschaftlichen Artikel über „Mariendistel – Silybum marianum“, veröffentlicht unter www.docjones.de, nach Eigendarstellung „Deutschlands größtes Portal für grüne Medizin“, der offensichtlich keine eigenen Erfahrungen und Beobachtungen des namentlich nicht benannten Autors schildert, der auch die Quellen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse nicht nennt und somit den Anforderungen an den erforderlichen Nachweis nicht genügt. Überdies verweist auch dieser Artikel nur auf die Wirkstoffe in den Früchten der Silberdistel.
bbb)
Artischocke
Der als Anlage BK 13 vorgelegte wikipedia-Artikel erläutert lediglich, der in der Artischocke enthaltene Bitterstoff Cynarin rege den Stoffwechsel von Leber und Galle an.
Bei der Anlage BK 14 handelt es sich um einen populärwissenschaftlichen Artikel über „Artischocke“, veröffentlicht in der Apotheken-Umschau, der lediglich vorsichtig formuliert: „Außerdem legen wissenschaftliche Untersuchungen nahe, dass die Artischocke die Lebertätigkeit unterstützt ….“. Außerdem wird in diesem Beitrag ausgeführt, dass nur bestimmte Blätter der Artischocke am Grund des Stengels und nicht die Hüllblätter am Blütenkopf arzneilich wirksam sind. Die Beklagte legt hingegen nicht dar, welche Bestandteile der Artischocke in ihrem Produkt enthalten sein sollen.
ccc)
Löwenzahn
Bei der Anlage BK 15 handelt es sich um einen populärwissenschaftlichen Artikel über „Löwenzahn“, veröffentlicht unter www.heilpflanzen-online.com, der offensichtlich keine eigenen Erfahrungen und Beobachtungen des namentlich nicht benannten Autors schildert, der auch die konkreten Quellen der einzelnen Informationen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse nicht nennt und somit den Anforderungen an den erforderlichen Nachweis nicht genügt.
Entsprechendes gilt die Anlage BK 16.
ddd)
Artischocke, Löwenzahn, Mariendistel
Bei der Anlage BK 17 handelt es sich um Auszüge aus einem populärwissenschaftlichen „Gesundheitsratgeber Gallensteine“, der offensichtlich keine eigenen Erfahrungen und Beobachtungen des Autors schildert, der auch die konkreten Quellen der einzelnen Informationen und den Umfang der Überprüfung der dort vorgestellten Erkenntnisse nicht nennt und somit den Anforderungen an den erforderlichen Nachweis nicht genügt.
eee)
Des weiteren fehlt es aber auch hier an einer Grundlage für den von der Beklagten zu führenden Nachweis, dass die fraglichen Stoffe in den Produkten der Beklagten jeweils in bioverfügbarer Form (Art. 5 Abs. 1 lit. c der HCVO) enthalten sind und bei einem vernünftigerweise zu erwartenden Verzehr die von der Beklagten behauptete Wirkung zu erzielen vermögen (Art. 5 Abs. 1 lit. d der HCVO). In diesem Zusammenhang ist insbesondere zu berücksichtigen, dass die Verwendung der entsprechenden Angaben nach dem insoweit eindeutigen Wortlaut der genannten Bestimmungen nur dann zulässig ist, wenn die behauptete positive Wirkung der jeweiligen Substanz bereits zu dem Zeitpunkt anhand allgemein anerkannter wissenschaftlicher Erkenntnisse nachgewiesen ist, zu dem die Angaben gemacht werden. (vgl. BGH GRUR 2013, 958 – Vitalpilze, Rn 21)
3.
Demzufolge hat das Landgericht dem Kläger zu Recht einen Anspruch auf Erstattung von Abmahnkosten zugesprochen (§ 12 Abs. 2 UWG).
Rechtshängigkeitszinsen (§§ 291, 288 Abs. 1 BGB) hat das Landgericht dem Kläger seit dem Tag der Zustellung der Klage zugesprochen. Der Anspruch auf Rechtshängigkeitszinsen steht dem Kläger jedoch entsprechend § 187 Abs. 1 BGB ab dem auf die Rechtshängigkeit des Zahlungsanspruchs folgenden Tag zu (vgl. BGH NJW-RR 1990, 518)
C.
Der Senat sieht keine Veranlassung, gemäß Art. 267 AEUV dem EuGH Fragen über die Auslegung der Verträge oder über die Gültigkeit und die Auslegung der Handlungen der Organe, Einrichtungen oder sonstigen Stellen der Union zur Entscheidung vorzulegen.
1.
Aus Art. 267 AEUV folgt, dass im vorliegenden Fall keine Vorlagepflicht besteht.
2.
Die Ausführungen der Beklagten in der mündlichen Verhandlung am 10. Juli 2015 lassen vermuten, dass die Beklagte die HCVO insgesamt als gegen den Vertrag über die Arbeitsweise der Europäischen Union verstoßend ansieht und sich in diesem Standpunkt durch die Haltung der Europäischen Kommission bestätigt sieht.
Die Europäische Kommission hat in Erwägungsgrund 5 zur Verordnung (EU) Nr. 536/2013 Bedenken hinsichtlich des Unterschieds bei der Berücksichtigung von Daten aufgrund der „traditionellen Verwendung“ gemäß der Verordnung (EG) Nr. 1924/2006 in Bezug auf gesundheitsbezogene Angaben einerseits und gemäß der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel in Bezug auf die Verwendung traditioneller Kräuterheilmittel andererseits geäußert.
Diesen Bedenken hat der Senat bei der Beurteilung, ob die beanstandeten Werbeaussagen durch allgemein anerkannte wissenschaftliche Nachweise abgesichert sind, Rechnung getragen.
Weitere Gesichtspunkte, die für eine „Verfassungswidrigkeit“ der Vorschriften der HCVO insgesamt sprechen, ergeben sich weder aus dem Vortrag der Beklagten noch aus bekannten Verlautbarungen der Europäischen Kommission.
3.
Die Frage, ob für die beanstandeten Angaben bei der EFSA Zulassungsantrag gemäß Art. 13 HCVO gestellt worden ist, ist nicht entscheidungsrelevant.
4.
Die Frage, ob gesundheitsbezogene Angaben nur für den jeweiligen Nährstoff, die Substanz oder das Lebensmittel gemacht werden dürfen, für die sie zugelassen sind, nicht aber für das Lebensmittelprodukt, das diese enthält, ist aus Sicht des Senats offenkundig und ohne vernünftigen Zweifel zu bejahen, so dass eine Vorlagepflicht nicht anzunehmen ist (vgl. EuGH NJW 1983, 1257).
Die Frage ist letztlich aber auch nicht entscheidungserheblich, da die beanstandeten Aussagen auch im Übrigen mit zulässigen Angaben nicht inhaltlich gleichzusetzen sind.
Dementsprechend besteht auch kein Anlass zu einer Vorlage der Frage, ob es zulässig ist, zugelassene „Claims“ mit anderen Worten zu beschreiben.
5.
Die Frage der Anwendbarkeit von Art. 28 Abs. 6 HCVO auf den vorliegenden Fall ist nicht entscheidungsrelevant, da – wie ausgeführt – auf der Grundlage des Tatsachenvortrages der Beklagten dessen Tatbestandsvoraussetzungen ohnehin nicht erfüllt sind.
D.
Die Kostenentscheidung folgt aus § 97 Abs. 1, § 92 Abs. 2 ZPO, die Entscheidung über die vorläufige Vollstreckbarkeit beruht auf § 708 Nr. 10, § 711 ZPO.
Die Revision ist nicht zuzulassen (§ 543 Abs. 2 S. 1 ZPO). Die Entscheidung folgt der höchstrichterlichen Rechtsprechung, und sie beruht auf den besonderen Umständen des vorliegenden Falles.